Neue Produkte und Verfahren zu entwickeln und Therapien zu verbessern gehört zu den festen Bestandteilen unserer Strategie. Wir richten unsere Forschungs- und Entwicklungsaktivitäten auf die Kernkompetenzen in folgenden Bereichen aus:
- Dialyse
- generische I.V.-Arzneimittel
- Biopharmazeutika
- Infusions- und Ernährungstherapien
- Medizintechnik
Neben neuen Produkten entwickeln und optimieren wir vor allem Therapien, Behandlungsverfahren und Dienstleistungen.
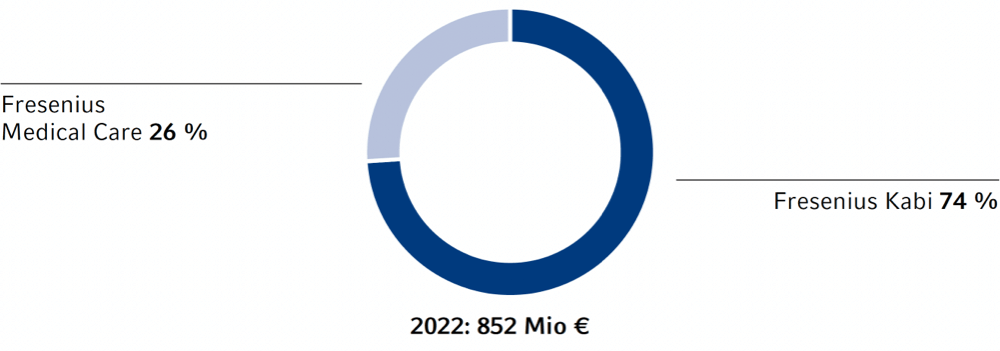
Forschungsleistungen Dritter nimmt im Wesentlichen Fresenius Kabi in Anspruch, insbesondere im Bereich Biopharmazeutika.
Forschungs- und Entwicklungsaufwand nach Bereichen1
1Vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm
Am 31. Dezember 2022 beschäftigten die Forschungs- und Entwicklungsbereiche 3.799 Mitarbeiterinnen und Mitarbeiter (2021: 3.656). Davon waren 1.235 für Fresenius Medical Care (2021: 1.236) und 2.525 für Fresenius Kabi (2021: 2.366) tätig.
Unsere Hauptentwicklungsstandorte liegen in Europa, den USA und Indien. Produktionsnahe Entwicklungstätigkeiten finden auch in China statt.
Die Aufwendungen1 für Forschung und Entwicklung betrugen im Berichtsjahr 852 Mio € (2021: 818 Mio €). Dies entspricht 7,2 % unseres Produktumsatzes (2021: 7,5 %).
1 2022;2021: Vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm; 2021: vor Umbewertungen von bedingten BiosimilarsBiosimilarsBiosimilars sind Nachahmerprodukte von biotechnologisch hergestellten Arzneimitteln, sogenannten Biopharmazeutika.-Kaufpreisverbindlichkeiten
Kennzahlen Forschung und Entwicklung
Download(XLS, 36 kB)| 2022 | 2021 | 2020 | 2019 | 2018 | |
|---|---|---|---|---|---|
| F & E-Aufwendungen in Mio €1 | 852 | 818 | 748 | 677 | 649 |
| in % vom Produktumsatz1, 2 | 7,2 % | 7,5 % | 7,2 % | 6,8 % | 6,7 % |
| F & E-Mitarbeiterinnen und Mitarbeiter | 3.799 | 3.656 | 3.565 | 3.412 | 3.042 |
| 1 2022, 2021: vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm 2021, 2020, 2019 und 2018: Umbewertungen von bedingten Biosimilars-Kaufpreis- verbindlichkeiten |
|||||
| 2 2022, 2021, 2019 und 2018 bereinigt um außerplanmäßige Abschreibungen auf erworbene Entwicklungsaktivitäten | |||||
Fresenius Medical Care
Bei Fresenius Medical Care treiben wir die Entwicklung neuer Produkte voran, die die Lebensqualität und die Behandlungsergebnisse unserer Patientinnen und Patienten kontinuierlich verbessern. Hierbei verfügen wir über ein umfangreiches Portfolio an Innovationsprojekten.
Wir konzentrieren uns auf Technologien sowohl in unserem Kerngeschäft als auch in verwandten Bereichen, die für uns von strategischem Interesse sind.
In Zukunft wollen wir noch effizienter innovative, wettbewerbsfähige Produkte bereitstellen. Wir haben daher im Rahmen unserer organisatorischen Neuausrichtung damit begonnen, unser bisher dezentralisiertes Produktgeschäft einschließlich Forschung und Entwicklung im Segment Care Enablement ab 1. Januar 2023 zu konsolidieren. Das Produktgeschäft wird dabei nach den drei Behandlungsmodalitäten, die wir anbieten, organisiert: Dialysezentren, Heimdialyse und Intensivmedizin.
Parallel zu den Forschungs- und Entwicklungsaktivitäten arbeiten wir mit externen Partnern zusammen, um unser umfassendes Innovations- und Technologienetz auszubauen. Dazu zählen zahlreiche akademische Einrichtungen, etwa Forschungsinstitute an namhaften Universitäten in den USA. Ein weiterer Partner ist das Renal Research Institute in New York. Diese Tochtergesellschaft von Fresenius Medical Care North America ist eine renommierte Institution auf dem Gebiet der klinischen Forschung rund um das chronische Nierenversagen. Gemeinsam befassen wir uns mit grundlegenden Fragen der Nierentherapie. Darüber hinaus arbeitet Fresenius Medical Care Ventures mit Start-up-Unternehmen und Unternehmen in der Frühphase zusammen, um eine offene Innovationskultur und den Zugang zu den neuesten Technologien zu fördern.
Zentrumsdialyse
Die FDAFDA (U.S. Food and Drug Administration)Die behördliche Lebensmittelüberwachungs- und Arzneimittelzulassungsbehörde der USA. hat die Hämodialysegeräte der Serie 2008 mit Silikonschläuchen, die Platinkatalysatoren enthalten, zugelassen. Die Platin-Katalysatorschläuche eliminieren nachweisbare nicht-dioxinähnliche (NDL) polychlorierte Biphenylsäuren (PCBAs) in Maschinen dieser Serie und tragen damit den im Mai 2022 durch die FDA geäußerten Bedenken Rechnung.
Heimdialyse
Für viele Menschen mit chronischem Nierenversagen ist die Peritonealdialyse die schonendste und damit bevorzugte Behandlungsoption während der ersten Jahre der Nierenersatztherapie. Unser Ziel für diese Form der Behandlung ist, die Therapiesysteme zugänglicher, intelligenter und vernetzter zu machen. Ein Beispiel dafür ist die digitale Therapieplattform Kinexus, die künftig alle APD (automatisierte Peritonealdialyse)-Cycler in unserem Portfolio unterstützen wird und Ärzten und Pflegepersonal einen ständigen Online-Zugang zu den Behandlungsdaten und die Fernprogrammierung individueller Verordnungen ermöglicht. Damit werden Behandlungsergebnisse weiter verbessert und die Produktivität des eingesetzten Pflegepersonals erhöht. Die Kinexus-Plattform ist bereits in Verbindung mit dem Liberty® Select Cycler erhältlich, ein auf dem US-Markt eingesetztes Peritonealdialysegerät, das im November 2022 die FDA-Zulassung für die zusätzliche Programmierung durch Ferntherapie erhalten hat. Diese digitale Innovation soll die Zahl der Krankenhausaufenthalte, der technischen Störungen und der Behandlungsabbrüche verringern. Sie verlängert zudem die für die Patienten in der Regel vorteilhafte durchschnittliche Verweildauer in der Peritonealdialyse. Darüber hinaus wird Kinexus als Basistechnologie für künftige Innovationen dienen.
SILENCIA heißt ein neuer APD-Cycler, der einen sehr einfachen, ultraleisen und äußerst zuverlässigen Mechanismus zur Flüssigkeitssteuerung auf Schwerkraftbasis nutzt, der die Durchführung einer qualitativ hochwertigen automatisierten Peritonealdialyse zu sehr geringen Kosten ermöglicht. Bei Behandlungen in Südamerika wurden bereits positive Ergebnisse in puncto Stabilität und Funktionalität des Systems erzielt. Ein Roll-out in Asien, im Nahen Osten und in Nordafrika ist geplant.
Auf dem chinesischen Markt haben wir im Geschäftsjahr 2022 die App „China CAPD“ (CAPD = Continuous Ambulatory Peritoneal Dialysis, kontinuierliche ambulante Peritonealdialyse) eingeführt, mit deren Hilfe Peritonealdialysepatientinnen und -patienten eigenständig Therapie- und Vitaldaten erfassen, Verbrauchsmaterial bestellen sowie den Bestellfortschritt und die Lieferung verfolgen können. Medizinischem Fachpersonal bietet die App die Möglichkeit, einen besseren Überblick über Therapieergebnisse zu gewinnen, Hausbesuche zu dokumentieren und zielgerichtete Trainingsinhalte für Patientinnen und Patienten bereitzustellen.
Intensivmedizin
Eine bewährte und wirkungsvolle Behandlungsoption für Patientinnen und Patienten mit einer akuten Nierenschädigung ist die kontinuierliche Nierenersatztherapie (Continuous Kidney Replacement Therapy, CKRT), bei der das Blut mithilfe spezieller Lösungen und Filter gereinigt wird. Dabei werden die natürlichen Funktionen der Niere nachgeahmt und eine kontinuierliche Kontrolle des Körperflüssigkeitshaushalts ermöglicht.
Mit dem NxStage System One ist eine weitere führende CKRT-Plattform in den USA erhältlich. Mit deren 2022 neu auf dem Markt eingeführten „Speed Swap“-Funktionalität ist ein Filtertausch während der Therapie ohne Wechsel des Behandlungssets möglich. Diese neue Option steigert die Attraktivität des Therapiesystems bei der täglichen Anwendung durch das Klinikpersonal.
Digitalisierung der Gesundheitsversorgung
Schwerpunkte bei der Digitalisierung der Prozesse in der Gesundheitsversorgung sind die Vernetzung von Patientinnen und Patienten, Ärztinnen, Ärzten und dem Pflegepersonal sowie die Verbesserung der pflegerischen Dokumentation am Point of Care. Damit sollen bessere Behandlungsergebnisse und eine signifikante Reduzierung der Behandlungskosten für unsere Patientinnen – und Patienten sowie eine Verbesserung unserer eigenen Kostenbasis erzielt werden.
Durch eine vernetzte Patientenversorgung wird es möglich sein, Behandlungen individuell abzustimmen sowie Warnsignale und Ursachen von Nierenerkrankungen frühzeitig zu erkennen. Durch Nutzung der weltweit größten Datenbank für klinische Daten im Bereich fortgeschrittener Nierenerkrankungen entwickeln wir hierfür Module, die auf künstlicher Intelligenz und maschinellem Lernen basieren, um Ärztinnen, Ärzte und Pflegekräfte in ihren Aufgaben zu unterstützen.
Forschung im Bereich der regenerativen Medizin
Weiter ausgebaut haben wir unsere Zusammenarbeit mit dem US-Pharmaunternehmen Humacyte, Inc. (Humacyte), einem Entwickler und Hersteller von universell implantierbaren biotechnologisch hergestellten menschlichen Geweben.
Das Humacyte Human Acellular Vessel (HAV) ist ein regeneratives Gefäßsystem, das für verschiedene vaskuläre Anwendungen eingesetzt wird, darunter die Reparatur von Gefäßverletzungen, arteriovenöse Zugänge für die Hämodialyse und periphere Arterienerkrankungen. Unsere Beteiligung an Humacyte ist aktuell das Investment mit dem fortgeschrittensten klinischen Programm und einer Markteinführung in weniger als zwei Jahren.
Fresenius Medical Care Ventures
Fresenius Medical Care Ventures investiert gezielt in Start-ups und Unternehmen in der Frühphase aus den Bereichen Diagnostik, Therapien, medizinische Geräte, digitale Lösungen, Xenotransplantation und Monitoringtechnologien. Ziel ist die Verbesserung der Behandlungsergebnisse für Patientinnen und Patienten, die an chronischen Krankheiten leiden oder eine Akutversorgung benötigen.
Fresenius Kabi
Die Forschungs- und Entwicklungsaktivitäten von Fresenius Kabi konzentrieren sich auf Produkte für die Therapie und Versorgung kritisch und chronisch kranker Patientinnen und Patienten. Unsere Produkte finden ihren Einsatz dort, wo Patientinnen und Patienten am stärksten gefährdet sind: in der Notfallmedizin, der Intensivmedizin, der Spezialversorgung und bei jenen, die über einen längeren Zeitraum im Krankenhaus oder ambulant behandelt werden müssen. Bei diesen Patientengruppen ist jeder einzelne Schritt wesentlich für den Therapieerfolg. Produkte von Fresenius Kabi tragen hier entscheidend zum Behandlungserfolg bei und das Zusammenspiel von Medizin und Technik ist von hoher Bedeutung.
Wir sehen es als unsere Aufgabe, Produkte zu entwickeln, die dazu beitragen, den medizinischen Fortschritt in der Akut- und Folgeversorgung zu fördern und die Lebensqualität von Patientinnen und Patienten zu verbessern. Gleichzeitig möchten wir mit unseren Produkten ermöglichen, dass weltweit immer mehr Menschen Zugang zu hochwertigen und modernen Therapien erhalten.
Weltweit nehmen chronische Erkrankungen zu. In der Versorgung von kritisch erkrankten Patientinnen und Patienten werden die Anforderungen an den Behandlungserfolg immer höher. Die Nachfrage nach effektiven Therapien im Zusammenspiel mit intelligenten medizintechnischen Anwendungen und Geräten wird auch in Zukunft steigen. Wir wollen der bevorzugte Ansprechpartner für Ärztinnen und Ärzte und das Pflegepersonal bei der Versorgung von kritisch und chronisch kranken Patientinnen und Patienten sein. Mit der Vision 2026 haben wir eine klare Richtung mit drei Wachstumspfaden für Fresenius Kabi definiert: die Verbreiterung unseres biopharmazeutischen Angebots, die Weiterentwicklung und globale Einführung unserer klinischen Ernährungsprodukte und die Expansion im Bereich MedTech. Im volumengetriebenen I.V.-Geschäft werden wir unsere Resilienz weiter ausbauen. Danach wird sich auch unsere zukünftige Entwicklungsarbeit ausrichten.
Unsere Entwicklungskompetenz umfasst alle relevanten Komponenten: den Arzneimittelrohstoff, die Arzneimittelformulierung, das Primärbehältnis, das medizintechnische Produkt zur Verabreichung von Arzneimitteln und Infusionen sowie die Herstellungstechnologie. Im Bereich Biopharmazeutika haben wir uns auf die Entwicklung von Produkten in den Bereichen Autoimmunerkrankungen und Onkologie spezialisiert.
Im biopharmazeutischen Bereich sind wir bestrebt, weitere therapeutische Lösungen für mehr Patientinnen und Patienten bereitzustellen. In beiden Therapiebereichen bauen wir unser Biosimilars-Portfolio weiter aus und haben mehrere Kandidaten in verschiedenen Entwicklungsphasen. Ein Biosimilar ist ein biologisches Produkt, das einem anderen zugelassenen biologischen Produkt, dem sogenannten „Referenzprodukt“, ähnlich ist. Das Biosimilar-Produkt weist ein ähnliches analytisches Profil, eine ähnliche PharmakokinetikPharmakokinetikDie Wirkung des Körpers auf das Arzneimittel., Wirksamkeit, Sicherheit und Immunogenität auf wie das Referenzprodukt. Die Einführung und Akzeptanz von Biosimilars hat weltweit zugenommen, und immer mehr Patientinnen und Patienten werden mit hochwertigen biologischen Arzneimitteln behandelt. Für viele bedeutet eine Therapie mit einem Biopharmazeutikum ein völlig neues Leben und der Zugang zu Biopharmazeutika hat sich in den letzten Jahren verbessert.
Mit unserem wachsenden Portfolio an Biosimilars bieten wir mehr Patientinnen und Patienten weltweit Zugang zu hochwertigen, sicheren, wirksamen und bezahlbaren Medikamenten. Für unsere Biosimilars-Produkte wenden wir bei der Forschung, Entwicklung und Herstellung dieselben hohen Qualitätsstandards an, die für das Referenzprodukt erforderlich sind.
Das Forschungs- und Entwicklungszentrum für Biosimilars hat seinen Sitz in Eysins in der Schweiz. Dort wird in hochmodernen Entwicklungs- und Forschungslaboratorien an neuen Biosimilars für die Behandlung von Autoimmun- und onkologischen Erkrankungen gearbeitet. Darüber hinaus hat Fresenius Kabi im Jahr 2022 eine Mehrheitsbeteiligung an mAbxience, einem führenden internationalen biopharmazeutischen Unternehmen, erworben.
Unser erstes Biosimilar ist Idacio1, ein Adalimumab-Biosimilar, das bei chronisch entzündlichen Erkrankungen wie rheumatoider Arthritis, Morbus Crohn und Psoriasis (Hauterkrankung) eingesetzt werden kann. Seit seiner Einführung im Jahr 2019 haben wir das Produkt in mehr als 37 Ländern in Europa, dem Nahen Osten, Nordamerika, Lateinamerika und Asien-Pazifik auf den Markt gebracht. Im Berichtsjahr haben wir an weiteren Marktzulassungen gearbeitet. Im Dezember 2022 erhielt Fresenius Kabi die Zulassung der U.S. Food and Drug Administration für Idacio.
Unser zweites Biosimilar Stimufend® 2 ist ein Pegfilgrastim-Biosimilar, ein Medikament zur Behandlung von Patientinnen und Patienten, die nach einer Chemotherapie eine Neutropenie erleiden. Es stimuliert das Wachstum bestimmter weißer Blutkörperchen, die für die Bekämpfung von Infektionen unerlässlich sind. Die Europäische Kommission hat Stimufend® für alle zugelassenen Indikationen des Referenzarzneimittels im 1. Quartal 2022 die Marktzulassung erteilt.
Im Berichtsjahr haben wir Stimufend® wie geplant in Frankreich eingeführt und die FDA hat im September 2022 ebenfalls unserem Pegfilgrastim-Biosimilar Stimufend® die Zulassung erteilt.
MSB 114563 ist ein Tocilizumab-Biosimilar-Kandidat, der bei verschiedenen Indikationen wie z. B. rheumatoider Arthritis eingesetzt wird. Fresenius Kabi hat im Berichtsjahr bekannt gegeben, dass die US-amerikanische Gesundheitsbehörde FDA (Food and Drug Administration) den 351 (k) Biologics License Application (BLA) für MSB 11456, den Biosimilars-Kandidaten für Actemra® (Tocilizumab), zur Prüfung angenommen hat. Der BLA-Antrag umfasst Darreichungsformen sowohl für die subkutane (Fertigspritze und Autoinjektor) als auch für die intravenöse Verabreichung, um den Patientinnen und Patienten, die Tocilizumab verwenden, ein umfassendes Angebot zu bieten.
Der Biosimilar-Kandidat für Tocilizumab ist nach Pegfilgrastim und Adalimumab der dritte BLA-Antrag, den der Unternehmensbereich bei der FDA eingereicht hat.
Im August 2022 hat Fresenius Kabi zusätzlich bekannt gegeben, dass die Europäische Arzneimittelagentur (EMA) den Zulassungsantrag für das Biosimilar RoActemra® mit dem Wirkstoff Tocilizumab (MSB 11456) zur Prüfung angenommen hat. Der Biosimilar-Kandidat für Tocilizumab ist der dritte Biosimilar-Kandidat von Fresenius Kabi, der in der Europäischen Union eingereicht wurde.
Neben den Biosimilars-Entwicklungstätigkeiten von Fresenius Kabi in der Schweiz entwickelt mAbxience in Spanien und Argentinien Biosimilars-Produkte. Bevacizumab und Rituximab, zwei der Biosimilars von mAbxience, die zur Behandlung verschiedener Krebsarten eingesetzt werden, sind seit vielen Jahren für Patientinnen und Patienten in mehr als 40 Ländern in Lateinamerika, in Asien-Pazifik und im Nahen Osten kommerziell verfügbar. Darüber hinaus erhielt mAbxience 2021 die EMA-Zulassung für sein Bevacizumab-Biosimilar, das somit in Europa erhältlich ist.
In den USA wurde die Marktzulassung für das Bevacizumab-Biosimilar von mAbxience von der FDA erteilt, sodass es seit Oktober 2022 auch für Patientinnen und Patienten in den USA erhältlich ist. Darüber hinaus erhielt mAbxience für das Bevacizumab-Biosimilar in fünf weiteren Ländern zwischen August und Dezember 2022 die Marktzulassung.
1 Idacio ist ein Biosimilar von Humira® und wurde noch nicht von allen Gesundheitsbehörden zugelassen. Humira® (Adalimumab) ist eine eingetragene Marke von AbbVie Biotechnology Ltd.
2 Stimufend® (Pegfilgrastim) ist eine eingetragene Marke der Fresenius Kabi Deutschland GmbH in ausgewählten Ländern; es ist ein Pegfilgrastim-Biosimilar von Neulasta® (Pegfilgrastim), einer eingetragenen Marke von Amgen Inc.
3 MSB 11456 ist ein Biosimilar-Kandidat zu Tocilizumab und wurde noch nicht von den zuständigen Gesundheitsbehörden zugelassen. Actemra® / RoActemra® (Tocilizumab) sind eingetragene Marken der Chugai Seiyaku Kabushiki Kaisha, ein Mitglied der Roche-Gruppe.
Klinische Ernährung dient der Versorgung von Patientinnen und Patienten, die keine oder nicht genügend reguläre Nahrung zu sich nehmen können. Dies betrifft beispielsweise Patientinnen und Patienten auf Intensivstationen sowie schwer und chronisch Kranke. Wird klinische Ernährung indikationsgerecht und frühzeitig eingesetzt, können Mangelernährung und deren Konsequenzen vermieden werden.
Mangelernährung ist ein häufiges Problem bei Krankenhauspatientinnen und -patienten: Studien, die in Europa durchgeführt wurden, zeigen, dass bei jedem vierten Patienten im Krankenhaus eine Mangelernährung bzw. das Risiko einer Mangelernährung vorliegt. Die klinische Bedeutung der Mangelernährung ergibt sich aus einer ungünstigeren Prognose hinsichtlich Morbidität und Mortalität. Weitere Folgen können ein längerer Krankenhausaufenthalt und höhere Behandlungskosten sein.
Im Produktsegment Parenterale ErnährungParenterale ErnährungZufuhr lebenswichtiger Nährstoffe direkt in die Blutbahn (intravenös). Sie wird notwendig, wenn der Zustand der Patientin oder des Patienten es nicht zulässt, dass Nährstoffe in ausreichender Menge oral oder als Trink- und Sondennahrung aufgenommen und verstoffwechselt werden. legen wir die Schwerpunkte im Bereich Forschung und Entwicklung auf Produkte, die helfen, zur Verbesserung der klinischen Behandlung und des Ernährungszustands von Patientinnen und Patienten beizutragen, sowie auf Behältnisse wie beispielsweise unsere MehrkammerbeutelMehrkammerbeutelDer Mehrkammerbeutel enthält alle Makronährstoffe wie Aminosäuren, Glukose und Lipide sowie Elektrolyte in separaten Kammern. Erst unmittelbar vor der Infusion werden durch einfaches Öffnen der einzelnen Kammern alle Nährstoffe im Beutel vermischt. Dies verringert das Kontaminationsrisiko und führt zu Zeitersparnis bei der Vorbereitung von Infusionen., die im medizinischen Alltag sicher und einfach anwendbar sind.
Im Jahr 2022 haben wir auch die Entwicklungsarbeit an parenteralen Produkten fortgeführt. Wir konzentrieren uns dabei auf Formulierungen, die auf die Bedürfnisse einzelner Patientengruppen ausgerichtet sind. Neben unseren globalen Entwicklungsprojekten arbeiten wir auch an Produkten zur parenteralen Ernährung für spezifische Märkte wie die USA, China und Europa.
Ein Schwerpunkt ist dabei der Einsatz von Fischöl in parenteraler Ernährung. Fischölhaltige parenterale Ernährung hat eine Vielzahl von positiven Auswirkungen auf wichtige biologische Funktionen einschließlich der Modulation der Immun- und Entzündungsreaktion. Der Einsatz von Fischöl in parenteralen Ernährungsprodukten kann dazu beitragen, dass sich klinische Ergebnisse verbessern und die Aufenthaltsdauer auf der Intensivstation und im Krankenhaus verkürzt wird.
Im Bereich Enterale ErnährungEnterale ErnährungZufuhr von Nährstoffen als Trink- und Sondennahrung unter Einbeziehung des Magen-Darm-Traktes. konzentrieren wir unsere Forschungs- und Entwicklungsaktivitäten auf Produktkonzepte, die die Therapietreue und damit den Therapieerfolg unterstützen. Insbesondere der Geschmack der enteralen Produkte ist als kritischer Parameter bekannt, um die Akzeptanz der Produkte und die Einhaltung der Ernährungstherapie zu gewährleisten. Seit Jahren arbeiten wir kontinuierlich daran, Produkte mit einer großen Vielfalt an Geschmacksrichtungen zu entwickeln, um den Anwendern Variationen anzubieten und sie damit bestmöglich zu unterstützen, die notwendige Ernährungstherapie durchzuführen. In dieser Hinsicht erweitern wir unser Angebot an pflanzlichen Produkten als Antwort auf die Nachfrage und die Vorlieben der Kunden. Ein weiterer Schwerpunkt unserer Arbeit ist die Entwicklung von Produkten mit erhöhter Kalorien- und Proteinkonzentration. Dadurch vereinfachen wir für den Anwender die Einnahme der notwendigen Menge an Nährstoffen in geringen Volumina. Neben globalen Produktentwicklungen arbeiten wir weiterhin an Produktentwicklungen für spezifische Markterfordernisse.
Im Bereich Medizintechnische Produkte liegt der Schwerpunkt auf der Entwicklung von Neuprodukten sowie auf der Weiterentwicklung unseres bestehenden Portfolios. Gerade diese Branche ist geprägt von technologischen Innovationen. Wie in keinem anderen unserer Produktsegmente ist hier Digitalisierung ein entscheidender Faktor. Geräte müssen nicht nur in ihrer Anwendung kontinuierlich weiterentwickelt werden, sondern zunehmend auch in die IT-Systemlandschaft von Krankenhäusern, Blutspende- und Plasmazentren eingebettet sein. Perspektivisch wollen wir von diesem Trend profitieren und legen bereits jetzt einen Schwerpunkt auf die kontinuierliche Weiterentwicklung unserer Softwarelösungen zur Steigerung der Effizienz und des Nutzens für unsere Kunden.
Im Rahmen der Übernahme des auf Infusionstherapien spezialisierten Unternehmens Ivenix durch Fresenius Kabi konzentrieren sich die Forschungs- und Entwicklungsaktivitäten des Unternehmensbereichs auf die Weiterentwicklung von Infusions-Management-Systemen (IMS) und deren Software, insbesondere im Hinblick auf Cybersicherheit, Workflow-Optimierung und Konnektivität mit verschiedenen Systemen für die elektronische Patientenakte.
Ferner haben wir im Berichtsjahr die Entwicklungsarbeit an unserem neuen Infusionsmanagementsystem Exelia fortgeführt. Dieses System ist mit einer modernen Bediensystematik ausgestattet und wird neue Therapie- und Behandlungsverfahren auf der Intensivstation und im Operationsraum ermöglichen. Fresenius Kabi wird Exelia kontinuierlich weiterentwickeln, um den fortschreitenden Anforderungen im Anwendungsbereich gerecht zu werden.
Im Berichtsjahr haben wir insbesondere die Entwicklung an der Vigilant Software Suite fortgeführt, eine Softwarelösung für unsere Infusionspumpenfamilie Agilia in Krankenhäusern.
In der Transfusionstechnologie arbeiten wir in der Forschung und Entwicklung intensiv an Produkten für den Einsatz im Bereich der Zelltherapie. Hierbei liegt unser Schwerpunkt auf Produktentwicklungen zum automatisierten Waschen und Aufkonzentrieren von Zellkonzentraten. Diese Produkte werden in der CAR-T-Zell¹- und ähnlichen Zelltherapien eingesetzt. Im Jahr 2022 haben wir das Zellverarbeitungsgerät CUE¹ erfolgreich auf den Markt gebracht. Dieses Gerät wurde speziell für kleinere Füllmengen und Endanwendungen im Zelltherapiebereich entwickelt und wird unser bereits im Markt erhältliches Zellverarbeitungsgerät LOVO1 ergänzen.
Im Bereich der extrakorporalen Photopherese (ECP) konzentrieren wir uns weiterhin auf die Einführung des Amicus-Blue-Systems und der dazugehörigen Lichtbox Phelix in Europa sowie auf die weitere Entwicklung eines Anwendungsverfahrens bei der ECP, bei dem nur ein Gefäßzugang erforderlich ist. Bei diesem Therapieverfahren werden bestimmte Blutzellen außerhalb des Körpers einer Behandlung mit ultraviolettem Licht (Phototherapie) unterzogen. Dieses Verfahren wird für die Behandlung verschiedener immunologischer Erkrankungen eingesetzt, u. a., um bösartige Immunzellen (Lymphozyten) außerhalb des Körpers abzutöten.
1 Weitere Informationen finden Sie im Glossar
Im Bereich generische I.V.-Arzneimittel arbeiten wir kontinuierlich an dem Ausbau unseres Produktangebots. So haben wir im Berichtsjahr das Produkt Romidepsin als Injektion eingeführt, eine Erweiterung unseres onkologischen Portfolios in den USA. Zum Zeitpunkt der Einführung war unser Produkt das einzige auf dem Markt befindliche Generikum zum Originalpräparat ISTODAX. Des Weiteren wurden die Produkte Bortezomib und Pemetrexed mit der Formierung eines generischen Marktes hierfür in den USA auf den Markt gebracht.
Darüber hinaus arbeiten wir an einer stetigen Verbesserung von bereits auf dem Markt befindlichen I.V.-Arzneimitteln. So entwickeln wir I.V.-Arzneimittel beispielsweise mit neuen Formulierungen und Darreichungsformen sowie in besseren Primärverpackungen. Im Jahr 2022 haben wir an etwa 100 Generikaprojekten gearbeitet. Unsere Forschungs- und Entwicklungsaktivitäten konzentrieren sich dabei u. a. auf komplexe Formulierungen, wie beispielsweise eine Emulsionslösung, die bereits als „first-to-file“-ANDA-Einreichung (Kurzantrag für neue Arzneimittel) in den USA bestätigt wurde, als auch Peptidformulierungen, die u. a. mit einem Autoinjektor appliziert werden. Darüber hinaus arbeiten wir stetig an Produktverbesserungen, die sowohl dem medizinischen Personal als auch Patientinnen und Patienten einen Zusatznutzen bringen. So entwickeln wir gebrauchsfertige Produkte, die besonders anwendungsfreundlich sind und dazu beitragen, Anwendungsfehler im medizinischen Alltag zu vermeiden. Dies sind z. B. sofort anwendungsbereite Fertiglösungen in unseren Freeflex-Infusionsbeuteln, die kosteneffiziente KabiPac-Infusionsflasche sowie vorgefüllte Spritzen. Arzneimittel in Fertigspritzen sind im Vergleich zur traditionellen Verabreichung einfacher und sicherer anzuwenden. Im Berichtsjahr haben wir in den USA sowohl Calcium Gluconate im Freeflex-Beutel als auch Glycopyrrolate in vorgefüllten Spritzen auf den Markt gebracht. In Europa haben wir u. a. Icatibant in vorgefüllten Spritzen eingeführt. Zudem haben wir das Medikament Dexamethasone, das essenziell für die Behandlung von Covid-19-Patienten ist, in weiteren europäischen Ländern ausgerollt.
Um die Arzneimittelsicherheit zu verbessern, setzt Fresenius Kabi ein globales Programm zur Einführung von Data-Matrix-Barcodes auf seinen generischen Medikamenten um. Diese Initiative soll Fehler bei der manuellen Eingabe von Medikamenteninformationen in Datenmanagementsystemen beispielsweise von Krankenhäusern, verhindern.
Im Bereich der Infusionslösungen haben wir unsere Entwicklungsaktivitäten wie in den vergangenen Jahren auf die Verbesserung und Entwicklung neuer Behältertechnologien konzentriert, um den Arbeitsalltag und die Sicherheit des medizinischen Fachpersonals zu verbessern. Im Berichtsjahr konnten wir Freeflex+, einen nadelfreien Injektionsanschluss, auf den Markt bringen und arbeiten an weiteren Projekten zur Ergänzung dieser Behälterreihe. Die Erweiterung unseres Produktportfolios für Infusionslösungen auf dem U.S.-amerikanischen Markt schreitet voran und wir befinden uns in den letzten Vorbereitungen, unser speziell für diesen wichtigen Markt entwickeltes Produktangebot vollständig auszurollen.

