Brief an die Aktionäre
Mit #FutureFresenius sind die strategischen Weichen gestellt für die Vereinfachung der Konzernstruktur, stärkere Fokussierung und verbesserte Performance.
WeiterlesenNachhaltigkeitsbericht
Fresenius steht im Herzen der Gesundheitsversorgung. Das Wohl unserer Patientinnen und Patienten leitet unser Handeln. Das betrifft Nachhaltigkeit auf allen Ebenen.
Mehr erfahrenStrategie und Management
Nachhaltigkeit voranzutreiben und damit eine solide Basis für zukünftige Herausforderungen zu schaffen, ist eine gemeinsame Aufgabe des gesamten Fresenius-Konzerns.
Patientenwohl
Als Gesundheitskonzern hat für uns die Sicherheit und das Wohlbefinden unserer Patientinnen und Patienten höchste Priorität.
Diversität
Bei Fresenius schaffen wir Voraussetzungen für ein diverses, inklusives und gleichberechtigtes Arbeits-umfeld, in das sich die Beschäftigten gut integrieren können.
Beschäftigte
Das Engagement unserer weltweit mehr als 300.000 Mitarbeiterinnen und Mitarbeiter ist die Grundlage unseres Erfolgs.
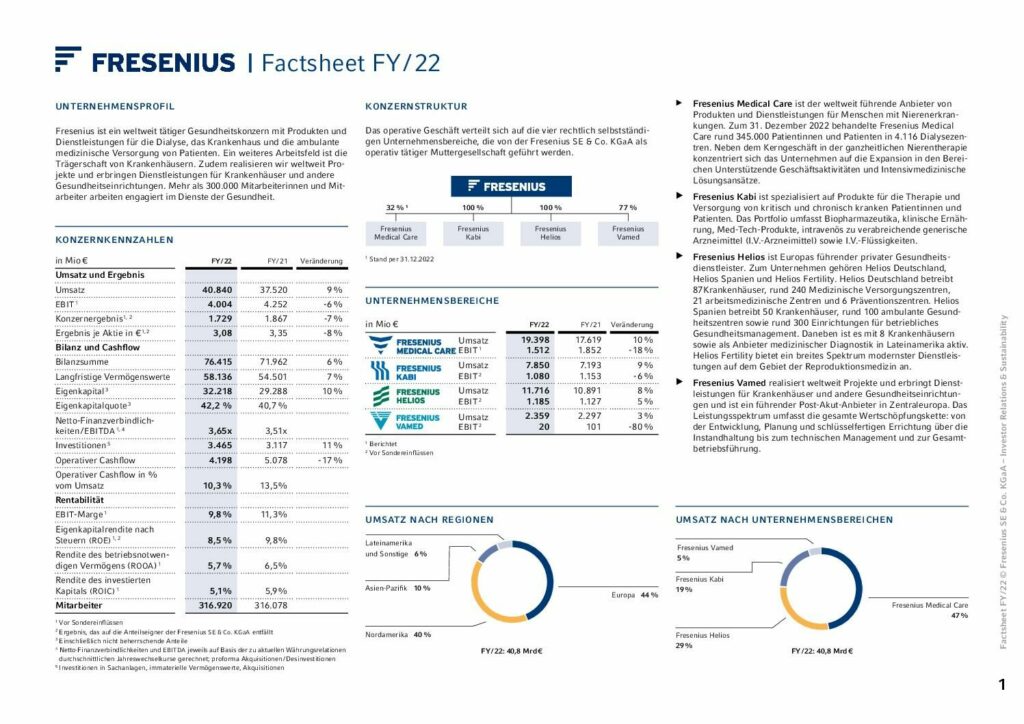
Finanz-Highlights
Trotz schwieriger Marktbedingungen haben wir im Geschäftsjahr 2022 unsere angepassten Konzern Umsatz- und Ergebnisziele erreicht.
Zu den Konzernzahlen
Umsatz
37.520 Mio €
+4 %1
FY/21: 37.520 Mio €
Zinsergebnis2
-504 Mio €
0 %1
FY/21: -504 Mio €
EBIT2
4.252 Mio €
-11 %1
FY/21: 4.252 Mio €
Beschäftigte
316.078
31. Dez. 2021: 316.078

Konzernergebnis2,3
1.867 Mio €
-10 %1
FY/21: 1.867 Mio €
Ergebnis je Aktie2,3
3,35 €
-13 %1
FY/21: 3,35 €
1 Währungsbereinigt
2 Vor Sondereinflüssen
3 Ergebnis, das auf die Anteilseigner der Fresenius SE & Co. KGaA entfällt

Lagebericht
Fresenius ist im Herzen der Gesundheitsversorgung. Unsere Dienstleistungen für Patienten, unsere klinischen Entscheidungen, unsere Arzneimittel, unsere medizinischen Geräte und Technologien – und vor allem unsere Patientenversorgung – stehen hierbei im Mittelpunkt. Unsere Mitarbeiterinnen und Mitarbeiter verbessern jeden Tag die Lebensqualität von Millionen von Menschen auf der ganzen Welt.
Zum Lagebericht