Ziele und Ambitionen
Ein wichtiges Ziel des Qualitätsmanagements von Fresenius Kabi ist es, die Anwendbarkeit, Wirksamkeit und Sicherheit von Produkten und Dienstleistungen sowie den Erfolg von Therapien zu verfolgen und kontinuierlich zu verbessern. Um dies zu gewährleisten, hat das Unternehmen ein integriertes Qualitätsmanagementsystem, ein Überwachungs- und Meldesystem sowie ein Produktrisikomanagement etabliert.
Ziele von Fresenius Kabi
Download(XLS, 35 kB)| Zeithorizont | Status 2023 | Weitere Informationen | |
|---|---|---|---|
| Überwachung des Nutzen-Risiko-Verhältnisses der Produkte: Compliance-Raten von 100 % bezogen auf die qualitätsbezogene Berichterstattung: Individuelle Nebenwirkungsmeldungen Übermittlung periodischer Sicherheitsberichte Übermittlung von Vigilanzdaten |
Fortlaufend | Ziele für 2023 teilweise erreicht | Richtlinien und Regularien |
Organisation und Verantwortlichkeiten
Die zentrale Qualitätsmanagementfunktion von Fresenius Kabi berichtet seit Dezember 2023 direkt an das Mitglied des erweiterten Führungsteams von Fresenius Kabi (Executive Leadership Team – ELT), das für die Funktion Technical Operations & Quality zuständig ist. Sie legt übergreifende Standards und Anforderungen für das Qualitätsmanagement des Unternehmensbereichs fest. Weitere Qualitätssicherungsfunktionen sind im gesamten Unternehmensbereich definiert, um die Einhaltung der unternehmensweiten Standards und Vorgaben zu gewährleisten.
Richtlinien und Regularien
Das Qualitätsmanagementsystem von Fresenius Kabi ist nach der Norm ISO 9001 organisiert und für alle Organisationen des Unternehmensbereichs verbindlich. Die Einhaltung der Norm wird von TÜV SÜD in jährlichen Audits auf globaler Ebene überprüft und umfasst 123 Fresenius Kabi-Organisationen durch eine Matrixzertifizierung; eine weitere Organisation verfügt über eine lokale ISO-9001-Zertifizierung. Darüber hinaus haben Produktionsstätten ergänzende Zertifizierungen, z. B. nach dem Standard ISO 13485 für Medizinprodukte, Lebensmittelsicherheit nach ISO 22000 oder im Allgemeinen die Good Manufacturing Practice (GMP) für Arzneimittel.
Qualitätsstandards Fresenius Kabi
Download(XLS, 36 kB)| Qualitätsstandard | ISO 9001 | ISO 13485 | GMP / cGMP |
|---|---|---|---|
| Anzahl zertifizierter Einheiten | 124 | 26 | 46 |
| Anzahl zertifizierter Einheiten, in %1 | 98 | 100 | 100 |
| 1 Angestrebte Abdeckung 100 % der relevanten Einheiten, Abweichungen aufgrund von organisatorischen Änderungen, z. B. Öffnung, Schließung von Standorten; prozentuale Abdeckung auf Basis der Einheiten, für die der Standard relevant ist. | |||
Mit internen Qualitätsaudits überprüft Fresenius Kabi regelmäßig die Effektivität des Qualitätsmanagementsystems sowie die Compliance mit internen und externen Standards und Vorgaben. Lieferanten unterliegen einem Qualifizierungsprozess, der sich an der Relevanz des zu liefernden Produkts oder der Dienstleistung für Fresenius Kabi orientiert. Auch die Qualifizierung von Lieferanten und ihre Rezertifizierung werden alle drei bis fünf Jahre auditiert. Entlang der Wertschöpfungskette von Fresenius Kabi finden zusätzlich Inspektionen durch Behörden sowie Audits durch unabhängige Organisationen und Kunden statt. Fresenius Kabi ergreift umgehend geeignete Gegenmaßnahmen, um bei den Prüfungen erkannte Schwachstellen oder Mängel zu beheben.
Integriertes Qualitätsmanagement Fresenius Kabi
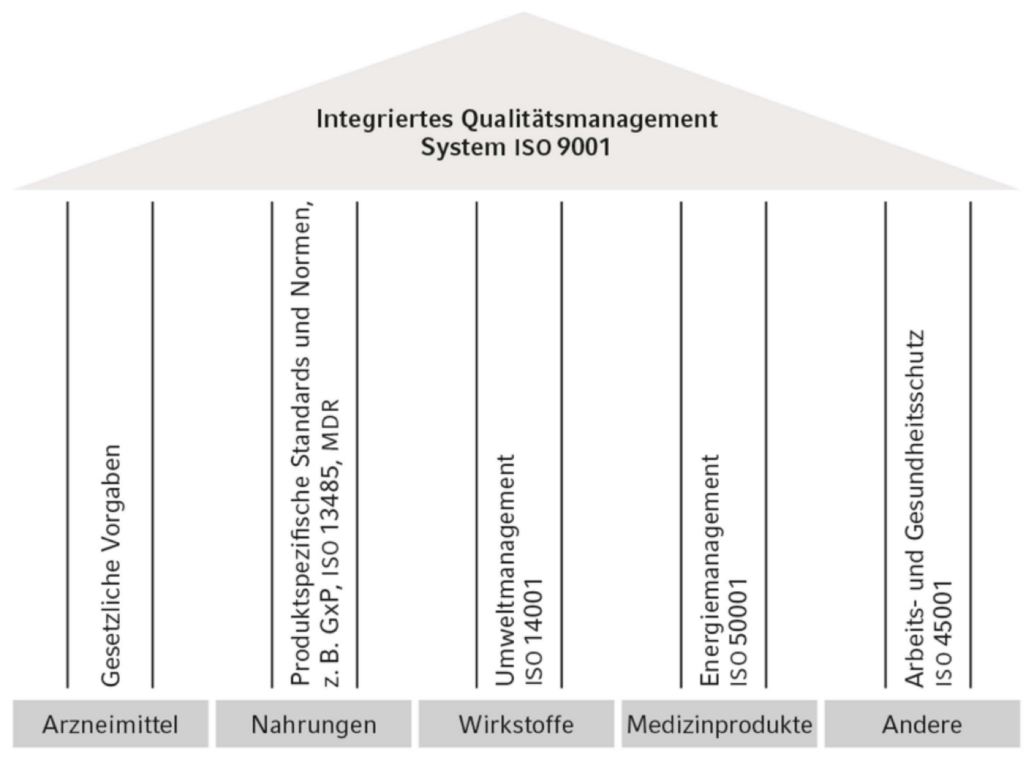
2023 wurden bei Fresenius Kabi insgesamt 58 interne Audits durchgeführt. Die externen Audits und Inspektionen beliefen sich im Berichtsjahr auf 111 (2022: 87), davon 22 GMP-Inspektionen, die durch die U.S. Food and Drug Administration (FDA), die australische Therapeutic Goods Administration (TGA), die kanadische Arzneimittelbehörde Health Canada sowie europäische Arzneimittelbehörden durchgeführt wurden. TÜV SÜD übernahm 15 Audits zum Qualitätsmanagementsystem (zertifizierende Einheit für den Standard ISO 9001).
Auf Basis der festgestellten Abweichungen errechnet Fresenius Kabi eine Audit- und Inspektionskennzahl. Hierzu wird die Anzahl der kritischen und schwerwiegenden Abweichungen, die bei den GMP-Inspektionen durch die oben genannten Behörden identifiziert wurden, mit der Anzahl der schwerwiegenden Abweichungen aus den ISO-9001-Audits durch TÜV SÜD zusammengenommen und durch die entsprechende Menge der insgesamt durchgeführten Inspektionen und Audits geteilt. Kritische Mängel oder Abweichungen, falls identifiziert, oder der Entzug des Zertifizierungsstatus werden zur Gewichtung mit einem vorgegebenen Faktor multipliziert. Die Kennzahl zeigt an, wie viele schwerwiegende Abweichungen bei den betrachteten Inspektionen und Audits durchschnittlich identifiziert wurden.
Audits und Inspektionen
Download(XLS, 46 kB)| 2023 | 2022 | 2021 | |
|---|---|---|---|
| Audit- und Inspektionskennzahl1 | 1,92 | 2,3 | 1,9 |
| Interne Audits | 58 | 45 | 58 |
| Externe Audits und Inspektionen | 111 | 87 | 94 |
Die Audit- und Inspektionskennzahl1 lag 2023 bei 1,92 (2022: 2,3). Festgestellte Mängel und Abweichungen wurden und werden zeitnah mittels korrektiver und präventiver Maßnahmen (Corrective and Preventive Actions – CAPA) beseitigt und Prüfungen zur Effektivität dieser Maßnahmen wurden und werden festgelegt. Die festgestellten Mängel und Abweichungen hatten keinen Einfluss auf die Erteilung von GMP-Zertifikaten bzw. des ISO-9001-Zertifikats.
2023 sind keine Ereignisse mit wesentlichen negativen Auswirkungen erfasst worden, die dem Erreichen der vorgenannten Qualitätsmanagementziele entgegenstehen.
1 Die Berechnung der Audit- und Inspektionskennzahl berücksichtigt alle im Berichtsjahr durchgeführten Audits und Inspektionen, zu denen Informationen zu Abweichungen bis Ende Januar des Folgejahres vorliegen.
2 Die Prüfung dieser Kennzahl als Teil der kurzfristigen variablen Vorstandsvergütung (STI) erfolgt mit hinreichender Prüfungssicherheit (reasonable assurance), wie ab Seite 201 im Vermerk des unabhängigen Wirtschaftsprüfers im Nichtfinanziellen Konzernbericht ausgeführt.
Überwachungs- und Meldesysteme
Die Überwachung unerwünschter Reaktionen oder Ereignisse (Nebenwirkungen) im Zusammenhang mit der Anwendung von Arzneimitteln wird als Pharmakovigilanz (Arzneimittelsicherheit) bezeichnet. Die gesetzlich festgelegten Pharmakovigilanz-Verpflichtungen beziehen sich auf Arzneimittel, die beim Menschen angewendet werden. Vergleichbare Vorschriften bestehen für Medizinprodukte. Fresenius Kabi hat für die kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses der Produkte verschiedene Standardverfahrensanweisungen etabliert und beurteilt deren erfolgreiche Durchführung anhand spezifischer Kennzahlen. Mithilfe der Vigilanzaktivitäten gewährleistet Fresenius Kabi die ständige Patientensicherheit der Produkte: So erkennt der Unternehmensbereich frühzeitig jede Änderung des Nutzen-Risiko-Verhältnisses seiner Produkte und kann rechtzeitig reagieren. Für das globale Vigilanzsystem sind die Funktionen der zentralen Sicherheitsbeauftragten (Corporate Safety Officers) von Fresenius Kabi verantwortlich. Diese Funktionen stellen sicher, dass der Unternehmensbereich schnell auf sicherheitsrelevante Ereignisse reagieren kann. Fresenius Kabi informiert seine Kunden und die Öffentlichkeit unverzüglich über festgestellte Mängel oder Maßnahmen der Produkt- und Patientensicherheit; dies kann direkt oder gegebenenfalls durch entsprechende Öffentlichkeitsarbeit geschehen.
Die Frühwarnsysteme sind so ausgestaltet, dass geschulte Reklamations- und Sicherheitsbeauftragte weltweit Reklamationen und Nebenwirkungen in IT-Systemen erfassen und entsprechende Informationen an Fachleute zur Prüfung weiterleiten.
Fresenius Kabi sammelt und bewertet einzelne Nebenwirkungsmeldungen und meldet sie nach regulatorischen Vorgaben weltweit an Gesundheitsbehörden. Der Unternehmensbereich hat sich zum Ziel gesetzt, alle Sicherheitsberichte in Übereinstimmung mit den geltenden Vorschriften einzureichen, und ist daher bestrebt, 100 % der individuellen Nebenwirkungsmeldungen rechtzeitig an die Behörden zu melden.
Darüber hinaus bewertet Fresenius Kabi regelmäßig das Nutzen-Risiko-Verhältnis der eigenen Produkte auf Basis von sicherheitsrelevanten Informationen aus verschiedenen Quellen (z. B. Nebenwirkungsmeldungen, medizinische Literatur). Die Ergebnisse dieser Analysen werden in Form von periodischen Sicherheitsberichten bei den Behörden eingereicht. Das Ziel von Fresenius Kabi ist es, alle periodischen Sicherheitsberichte weltweit rechtzeitig bei den Behörden einzureichen. Das Nutzen-Risiko-Verhältnis von allen pharmazeutischen Produkten blieb 2023 unverändert.
Als pharmazeutisches Unternehmen ist Fresenius Kabi verpflichtet, sein Vigilanzsystem gemäß regulatorischen Vorgaben in einer Pharmakovigilanz-Stammdokumentation (Pharmacovigilance System Master File – PSMF) zu beschreiben. Aus allen lokalen Fresenius Kabi-Marketing- und -Vertriebsorganisationen erfasst das Unternehmen dafür quartalsweise entsprechende Vigilanzdaten im PSMF und wertet diese aus. Das Ziel ist es, rechtzeitig Daten aller weltweiten Marketing- und Vertriebsorganisationen zu erhalten.
Compliance-Raten Qualität
Download(XLS, 35 kB)| in % | 2023 | 2022 |
|---|---|---|
| Individuelle Nebenwirkungsmeldungen rechtzeitig gemeldet (global) | 99,9 | 99,3 |
| Nutzen-Risiko-Verhältnis: rechtzeitige Übermittlung periodischer Sicherheitsberichte (global) | 99,1 | 100 |
| Rechtzeitige Übermittlung Vigilanzdaten intern | 100 | 100 |
Neben der rechtzeitigen Bewertung und Meldung einzelner Nebenwirkungen an die Behörden werden auch kumulative Bewertungen von Nebenwirkungen vorgenommen, um die Sicherheit der Produkte zu gewährleisten (SignalerkennungSignalerkennungVerschiedene Aktivitäten, anhand derer ermittelt wird, ob in Verbindung mit einem Wirkstoff oder Arzneimittel neue Risiken bestehen oder ob sich uns bekannte Risiken geändert haben. Grundlage einer Prüfung sind unsere Sicherheitsberichte, aggregierte Daten aus den Pharmakovigilanz-Systemen sowie Studien und Informationen aus der wissenschaftlichen Literatur oder anderen uns vorliegenden Datenquellen. Zum Signalmanagement gehört auch die Bewertung neuer Erkenntnisse und damit zusammenhängender Empfehlungen, Entscheidungen, Mitteilungen sowie die Nachverfolgung.). Dazu gehören wichtige Ereignisse, z. B. Meldungen über eine Nebenwirkung mit tödlichem Ausgang, um zu bewerten, ob neue Informationen über ein bekanntes Nebenwirkungsprofil oder eine neue Nebenwirkung eines Produkts vorliegen, die das Nutzen-Risikoprofil verändern. Im Berichtsjahr wurden keine solchen Informationen für die Produkte des Unternehmensbereichs bekannt.
Im Berichtsjahr 2023 hat Fresenius Kabi erneut sehr hohe Werte für die qualitätsbezogene Berichterstattung erreicht. Sofern Ziele nicht erreicht wurden, sind bereits Maßnahmen intern initiiert worden, um eine rechtzeitige Übertragung der Berichte zukünftig sicherzustellen.
Produktrisikomanagement
Weltweit verantwortliche Sicherheitsbeauftragte reagieren unverzüglich, sobald Fresenius Kabi Kenntnis von einem qualitätsrelevanten Ereignis erlangt. Sie initiieren und koordinieren weltweit notwendige Maßnahmen wie Produktrückrufe. Mit dem Frühwarnsystem evaluiert Fresenius Kabi qualitätsrelevante Informationen aus verschiedenen Risikofeldern, um frühzeitig Risiken zu identifizieren und Vorsorge- oder Gegenmaßnahmen einzuleiten. Fresenius Kabi nutzt dafür Datenbanken, in denen Reklamationen und Nebenwirkungen erfasst werden, interne und externe Audits sowie Kennzahlen, die der internen Steuerung und Optimierung der Qualitätsprozesse dienen. Auf diese Weise können die Sicherheitsprofile der Produkte weltweit kontinuierlich bewertet werden.
Interne Verfahren stellen sicher, dass wir umgehend und angemessen reagieren können, wenn bei einem unserer Produkte neue Nebenwirkungsmeldungen identifiziert wurden. Diese neuen Nebenwirkungen werden medizinischen Fachkräften in einem bestimmten Format, dem Dear Health Care Professional Letter, zeitnah mitgeteilt. So können wir sicherstellen, dass die Patientinnen und Patienten mit Produkten behandelt werden, die unseren Sicherheitsstandards entsprechen. Im Berichtsjahr hat sich das Nutzen-Risiko-Verhältnis bei keinem Produkt aufgrund neuer Nebenwirkungen verändert.
Kommunikation neuer Nebenwirkungen
Download(XLS, 35 kB)| 2023 | 2022 | |
|---|---|---|
| Anzahl der Kommunikationen an medizinisches Fachpersonal bezüglich neuer Nebenwirkungen zu einem Produkt | 1 | 1 |
Kennzeichnung und Produktinformation
Die Produkte von Fresenius Kabi werden auf der Grundlage globaler bzw. nationaler Vorschriften und Standards klassifiziert, z. B. als Arzneimittel, Ernährungsprodukte, pharmazeutische Wirkstoffe oder Medizinprodukte. Die Vermarktung dieser Produkte unterliegt verschiedenen gesetzlichen Anforderungen und Vorschriften, um eine vollständige und faktenbasierte Produktinformation zu gewährleisten. Fresenius Kabi verfügt über eine globale Richtlinie und globale Standardverfahrensanweisungen für seine Produktinformationen, um sicherzustellen, dass diese den geltenden Gesetzen und Vorschriften entsprechen und die Produktinformation zur korrekten Anwendung klar, genau und nicht irreführend ist.
Auch unterliegen die Produkte von Fresenius Kabi bestimmten Kennzeichnungsanforderungen. Die Kennzeichnung der Produkte wird regelmäßig im Rahmen der Regulierungen und Aktivitäten zur Vigilanz – also zur Einhaltung von Gesetzen bezogen auf Arzneimittelnebenwirkungen – überprüft und bei Bedarf aktualisiert. Die Produktkennzeichnung wird z. B. erneuert, wenn die zuständigen Behörden, wie etwa der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittelagentur (EMA), relevante Informationen veröffentlichen. Die zuständige Funktion von Fresenius Kabi verwendet ein elektronisches Managementsystem für Produktkennzeichnungen, um die für die Kennzeichnung notwendigen Informationen oder gedrucktes Verpackungsmaterial für die Etikettierung zu verwalten und deren Richtigkeit sicherzustellen. Richtungsweisend sind in diesem Zusammenhang auch die EU-Richtlinie über gefälschte Arzneimittel oder der US-amerikanische Drug Supply Chain Security Act (DSCSA). Fresenius Kabi berücksichtigt deren Vorgaben und hat hierzu für die relevanten Produkte entsprechende Prozesse zur SerialisierungSerialisierungKennzeichnung einer Arzneimittelpackung mit einer individuellen Seriennummer, die mit der Artikelnummer (GTIN), der Chargennummer und dem Verfallsdatum kombiniert wird. Diese Kombination wird in einem 2D-Data-Matrix-Code verschlüsselt, über den bei der Arzneimittelabgabe die Echtheit des Arzneimittels verifiziert wird., Prüfung und Nachverfolgbarkeit eingeführt. Weitere Informationen zur Transparenz im Gesundheitsbereich finden Sie im Kapitel Strategie und Management.
Kontakt
Fresenius SE & Co. KGaA
Group ESG
sustainability@fresenius.com

