Neue Produkte und Verfahren zu entwickeln und Therapien zu verbessern gehört zu den festen Bestandteilen unserer Wachstumsstrategie. Wir richten unsere Forschungs- und Entwicklungsaktivitäten auf die Kernkompetenzen in folgenden Bereichen aus:
- Dialyse
- generische I.V.-Arzneimittel
- Biosimilars
- Infusions- und Ernährungstherapien
- Medizintechnik
Neben neuen Produkten entwickeln und optimieren wir vor allem Therapien, Behandlungsverfahren und Dienstleistungen.
Forschungsleistungen Dritter nimmt im Wesentlichen Fresenius Kabi in Anspruch, insbesondere im Bereich Biosimilars. Details hierzu finden Sie auf Seite 310 im Konzern-Anhang.
Am 31. Dezember 2021 beschäftigten die Forschungs- und Entwicklungsbereiche 3.656 Mitarbeiterinnen und Mitarbeiter (2020: 3.565). Davon waren 1.236 für Fresenius Medical Care (2020: 1.262) und 2.366 für Fresenius Kabi (2020: 2.288) tätig.
Unsere Hauptentwicklungsstandorte liegen in Europa, den USA und Indien. Produktionsnahe Entwicklungstätigkeiten finden auch in China statt.
Die Aufwendungen1 für Forschung und Entwicklung betrugen im Berichtsjahr 818 Mio € (2020: 748 Mio €). Dies entspricht 7,5 % unseres Produktumsatzes (2020: 7,2 %).
1 Vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm und Umbewertungen von bedingten BiosimilarsBiosimilarsBiosimilars sind Nachahmerprodukte von biotechnologisch hergestellten Arzneimitteln, sogenannten Biopharmazeutika.-Kaufpreisverbindlichkeiten
Kennzahlen Forschung und Entwicklung
Download(XLS, 36 kB)| 2021 | 2020 | 2019 | 2018 | 2017 | |
|---|---|---|---|---|---|
| F & E-Aufwendungen in Mio €1 | 818 | 748 | 677 | 649 | 538 |
| in % vom Produktumsatz1, 2 | 7,5 % | 7,2 % | 6,8 % | 6,7 % | 5,7 % |
| F & E-Mitarbeiterinnen und Mitarbeiter | 3.656 | 3.565 | 3.412 | 3.042 | 2.772 |
| 1 2021: Vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm und Umbewertungen von bedingten Biosimilars-Kaufpreisverbindlichkeiten 2020, 2019 und 2018: Umbewertungen von bedingten Biosimilars-Kaufpreisverbindlichkeiten |
|||||
| 2 2021, 2019 und 2018 bereinigt um außerplanmäßige Abschreibungen auf erworbene Entwicklungsaktivitäten | |||||
Forschungs- und Entwicklungsaufwand nach Bereichen1
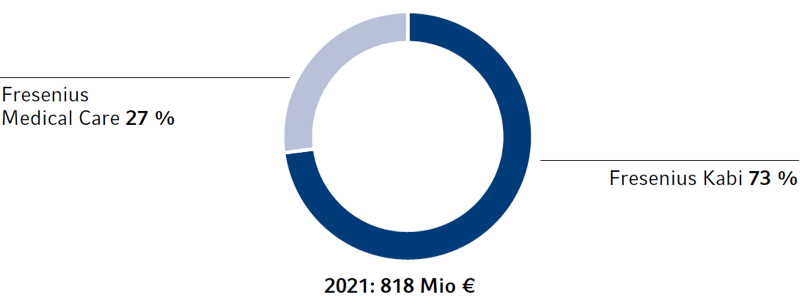
1 Vor Aufwendungen im Zusammenhang mit dem Fresenius Kosten- und Effizienzprogramm und Umbewertungen von bedingten Biosimilars-Kaufpreisverbindlichkeiten
Fresenius Medical Care
Unser Ziel ist es, die Lebensqualität unserer Patientinnen und Patienten und die Behandlungsergebnisse kontinuierlich zu verbessern. Unsere Intention ist daher, die Entwicklung neuer Produkte bis zur Markteinführung voranzutreiben und unser umfangreiches Portfolio an Innovationsprojekten auszubauen. Diese konzentrieren sich auf Technologien in unserem Kerngeschäft sowie auf verwandte Bereiche von strategischem Interesse.
Wir wollen innovative, wettbewerbsfähige Produkte anbieten und unseren Fokus auf die Entwicklungsländer weiter verstärken.
Zusätzlich zu den Forschungs- und Entwicklungsaktivitäten innerhalb unseres Unternehmens arbeiten wir mit externen Partnern zusammen, mit dem Ziel, ein umfassendes Innovations- und Technologienetzwerk aufzubauen. Zu diesen Partnern gehören zahlreiche akademische Einrichtungen, wie z. B. Forschungsinstitute an renommierten Universitäten in den USA. Eine weitere Einrichtung ist das Renal Research Institute (RRI) in New York. Diese Tochtergesellschaft von Fresenius Medical Care North America ist eine anerkannte Einrichtung auf dem Gebiet der klinischen Forschung zu allen Aspekten des chronischen Nierenversagens. Gemeinsam arbeiten wir an grundlegenden Fragen der Nierenersatztherapie. Zunehmend arbeiten wir auch mit Start-up-Unternehmen und Unternehmen in der Frühphase zusammen, um Innovationen zu fördern und den Zugang zu den neuesten Technologien zu ermöglichen.
Die Covid-19-Pandemie hatte keinen wesentlichen Einfluss auf unsere Aktivitäten in der Forschung und Entwicklung. Im Berichtsjahr haben wir unsere Forschungs- und Entwicklungsarbeit fortgeführt.
Der neue DialysatorDialysatorSpezieller Filter, der in der Hämodialyse zur Entfernung von Schadstoffen und Endprodukten des Stoffwechsels sowie zur Abscheidung überschüssigen Wassers aus dem Blut verwendet wird. Häufig als „künstliche Niere“ bezeichnet. FX CorAL wurde auf dem virtuellen „ERA-EDTA“-Kongress (European Renal Association ‒ European Dialysis and Transplant Association-Kongress) im Juni 2021 offiziell vorgestellt. Bei der Entwicklung des FX CorAL standen die klinische Performance und die HämokompatibilitätHämokompatibilitätBlutverträglichkeit im Vordergrund, beides wichtige Faktoren bei der patientenorientierten Dialyse. Der Dialysator basiert auf der innovativen Helixone hydro® Membran, die einen wässrigen Film auf der inneren Membranoberfläche bildet. Dadurch wird die Proteinadsorption verringert, mit der Folge einer abgeschwächten Immunreaktion und hohen selektiven Durchlässigkeit der Membran. Ziel ist hier, die Nebenwirkungen der Dialysebehandlung zu reduzieren.
Die multiFiltratePRO ist eine hochinnovative Plattform für die kontinuierliche Nierenersatztherapie. Sie bietet erweiterte Funktionen wie die Nierenersatztherapie unter Einbindung der bewährten regionalen Ci-Ca®-Citrat-Antikoagulation und den therapeutischen Plasmaaustausch. Die multiFiltratePRO hat eine Notfallzulassung in den USA erhalten und wurde 2020 in China sowie in einigen weiteren südamerikanischen Ländern eingeführt, sodass er nun über eine breite Basis im Markt verfügt. 2022 wollen wir auf Grundlage der deutlich gestiegenen Zahl der Geräte im Markt und des verstärkten Vertriebs weiter wachsen und Optimierungsmaßnahmen vornehmen; die Entwicklung der entsprechenden Maßnahmen wurde 2021 vorangetrieben und ist inzwischen fast abgeschlossen.
Fresenius Kabi
Die Forschungs- und Entwicklungsaktivitäten von Fresenius Kabi konzentrieren sich auf Produkte für die Therapie und Versorgung kritisch und chronisch kranker Patientinnen und Patienten. Unsere Produkte finden ihren Einsatz dort, wo Patientinnen und Patienten am stärksten gefährdet sind: in der Notfallmedizin, der Intensivmedizin, der Spezialversorgung und bei jenen, die über einen längeren Zeitraum im Krankenhaus oder ambulant behandelt werden müssen. Bei diesen Patientengruppen ist jeder einzelne Schritt wesentlich für den Therapieerfolg. Produkte tragen hier entscheidend zum Behandlungserfolg bei und das Zusammenspiel von Medizin und Technik ist von hoher Bedeutung.
Wir sehen es als unsere Aufgabe, Produkte zu entwickeln, die dazu beitragen, den medizinischen Fortschritt in der Akut- und Folgeversorgung zu fördern und die Lebensqualität von Patientinnen und Patienten zu verbessern. Gleichzeitig möchten wir mit unseren Produkten ermöglichen, dass weltweit immer mehr Menschen Zugang zu hochwertigen und modernen Therapien erhalten.
Weltweit nehmen chronische Erkrankungen zu. Immer mehr Menschen brauchen Zugang zu hochwertigen Therapien. In der Versorgung von kritisch erkrankten Patientinnen und Patienten werden die Anforderungen an den Behandlungserfolg immer höher. Die Nachfrage nach effektiven Therapien im Zusammenspiel mit intelligenten medizintechnischen Anwendungen und Geräten wird auch in Zukunft steigen. Wir wollen der bevorzugte Ansprechpartner für Ärztinnen und Ärzte und Pflegepersonal bei der Versorgung von kritisch und chronisch kranken Patientinnen und Patienten sein. Dafür wurde im Berichtsjahr die Fresenius Kabi Vision 2026 entwickelt und im 4. Quartal 2021 verabschiedet. Mit der Vision 2026 haben wir für Fresenius Kabi eine klare Richtung mit drei Wachstumspfaden definiert: die Verbreiterung unseres biopharmazeutischen Angebots, die Weiterentwicklung und globale Einführung unserer klinischen Ernährungsprodukte und die Expansion im Bereich MedTech. Im volumengetriebenen IV-Geschäft werden wir unsere Resilienz weiter ausbauen. Danach wird sich auch unsere zukünftige Entwicklungsarbeit ausrichten.
Unsere Entwicklungskompetenz umfasst alle relevanten Komponenten: den Arzneimittelrohstoff, die Arzneimittelformulierung, das Primärbehältnis, das medizintechnische Produkt zur Verabreichung von Arzneimitteln und Infusionen sowie die Herstellungstechnologie. Im Bereich Biosimilars haben wir uns auf die Entwicklung von Produkten in den Bereichen Autoimmunerkrankungen und Onkologie spezialisiert.
Im Bereich generische I.V.-Arzneimittel arbeiten wir kontinuierlich an dem Ausbau unseres Produktangebots. Dabei kommt es uns vor allem darauf an, neue generische Produkte zeitnah zum Patentablauf der Originalpräparate auf den Markt zu bringen. So haben wir im Berichtsjahr die Einführung des Krebsmedikaments Pemetrexed 25 mg / ml Konzentrat zur Herstellung einer Infusionslösung in Europa am 1. Juni und somit 2 Wochen vor Patentablauf, basierend auf einer Patentvereinbarung mit dem Originalhersteller, auf den Markt gebracht. Des Weiteren haben wir das Produkt Foscarnet Sodium Injektion in den USA eingeführt. Zum Zeitpunkt der Einführung im Februar 2021 war unser Produkt das einzige Generikum zum Originalpräparat Foscavir auf dem Markt. Foscarnet wird vor allem zur Behandlung von immunsupprimierten Personen eingesetzt. Darüber hinaus arbeiten wir an einer stetigen Verbesserung von bereits auf dem Markt befindlichen I.V.-Arzneimitteln. So entwickeln wir I.V.-Arzneimittel beispielsweise mit neuen Formulierungen und Darreichungsformen sowie in besseren Primärverpackungen. Im Jahr 2021 haben wir an mehr als 100 Generikaprojekten gearbeitet.
Wir konzentrieren uns dabei u. a. auf komplexe Formulierungen, beispielsweise auf Wirkstoffe in liposomalen¹ Lösungen, und Produktverbesserungen, die sowohl dem medizinischen Personal als auch Patientinnen und Patienten einen Zusatznutzen bringen. So entwickeln wir gebrauchsfertige Produkte, die besonders anwendungsfreundlich sind und dazu beitragen, Anwendungsfehler im medizinischen Alltag zu vermeiden. Dies sind z. B. Fertiglösungen in unseren freeflex-Infusionsbeuteln, die kosteneffiziente KabiPac-Infusionsflasche sowie vorgefüllte Spritzen. Arzneimittel in Fertigspritzen sind im Vergleich zur traditionellen Verabreichung einfacher und sicherer anzuwenden. Im Berichtsjahr haben wir z. B. Fentanyl in einer vorgefüllten Spritze in den USA eingeführt.
1 Liposome sind kleine Vesikel, die aus einer Lipiddoppelschicht und einem wässrigen Kern bestehen und für den Transport von Wirkstoffen im Körper eingesetzt werden.
Im Bereich Biosimilars verfügen wir über eine Pipeline von Molekülen in unterschiedlichen Entwicklungsstadien, die auf Autoimmunerkrankungen und Onkologie ausgerichtet ist. Ein Biosimilar ist ein biologisches Produkt, das einem anderen zugelassenen biologischen Produkt, welches als „Referenzprodukt“ bezeichnet wird, sehr ähnlich ist. Das Biosimilar-Produkt entspricht in Bezug auf Wirksamkeit und Sicherheit dem Referenzprodukt. Seit es Biosimilars gibt, werden immer mehr Patientinnen und Patienten mit biopharmazeutischen Arzneimitteln versorgt. Für viele bedeutet die Biopharmazeutika-Therapie ein völlig neues Leben. Es werden nicht nur mehr Menschen mit einem Biopharmazeutikum behandelt, auch die Wartezeit dafür hat sich in den letzten Jahren deutlich verkürzt.
Für unsere Biosimilars-Produkte wenden wir bei der Entwicklung und Herstellung dieselben hohen Qualitätsstandards an, die für das Referenzprodukt erforderlich sind. Mit unseren Biosimilars bieten wir weltweit mehr Patientinnen und Patienten Zugang zu bezahlbaren und qualitativ hochwertigen Medikamenten.
Das Forschungs- und Entwicklungszentrum für Biosimilars hat seinen Sitz in Eysins in der Schweiz. Dort wird in hochmodernen Entwicklungs- und Forschungslaboratorien an neuen Produkten für die Behandlung von Autoimmun- und onkologischen Erkrankungen gearbeitet.
Unser erstes Biosimilar ist Idacio1, ein Adalimumab-Biosimilar, das bei chronisch entzündlichen Erkrankungen wie rheumatoider Arthritis, Morbus Crohn und Psoriasis (Hauterkrankung) eingesetzt werden kann. Seit seiner Einführung im Jahr 2019 haben wir das Produkt in zahlreichen Ländern in Europa, Lateinamerika, Asien-Pazifik sowie auch in Israel und Kanada auf den Markt gebracht. Im Berichtsjahr haben wir an weiteren Marktzulassungen gearbeitet.
Die klinische Entwicklung von MSB 114552, einem Pegfilgrastim-Biosimilar-Kandidaten, wurde erfolgreich abgeschlossen und die Anträge zur Marktzulassung werden derzeit von der europäischen Arzneimittel-Agentur EMA und der US-Lebensmittelüberwachungs- und Arzneimittelbehörde (FDAFDA (U.S. Food and Drug Administration)Die behördliche Lebensmittelüberwachungs- und Arzneimittelzulassungsbehörde der USA.) auf Genehmigung für die Markteinführung geprüft. MSB 11455 ist ein Molekül, dass das Wachstum bestimmter weißer Blutkörperchen anregt. Diese Blutkörperchen sind essenziell für die Bekämpfung von Infektionen, die eine häufig auftretende Nebenwirkung bei Krebspatientinnen und -patienten sind, die eine Chemotherapie erhalten. Für die Genehmigung zur Markteinführung in den USA ist es erforderlich, das die FDA Inspektionen in den europäischen Produktionsstätten für MSB 11455 durchführt. Die FDA hat Fresenius Kabi im Berichtsjahr über den Aufschub des Abschlusses ihres Überprüfungsverfahrens informiert, da Covid-19-bezogene Beschränkungen die FDA-Inspektionen weltweit verzögern. Infolgedessen hat die FDA auch ihre Zulassungsentscheidung verschoben, bis die Inspektionen durchgeführt und abgeschlossen werden können.
MSB 114563 ist ein Tocilizumab-Biosimilar-Kandidat, der bei verschiedenen Indikationen wie z. B. rheumatoider Arthritis eingesetzt wird. Die mit gesunden, freiwilligen Probanden durchgeführte klinische Studie mit MSB 11456 erreichte im Jahr 2019 ihren primären Endpunkt und zeigte BioäquivalenzBioäquivalenzDer Arzneimittelwirkstoff des Generikums ist wirkstoffgleich zu dem des vergleichbaren Originalpräparats. Beide sind somit miteinander austauschbar. bei allen pharmakokinetischen Parametern. Im Berichtsjahr konnten wir unseren nächsten Entwicklungsschritt für die Markteinführung erfolgreich abschließen. Unser Biosimilar-Kandidat MSB 11456 zeigte positive Ergebnisse in zwei konsekutiv durchgeführten klinischen Phase-I-Studien und erreichte erfolgreich die primären und sekundären Endpunkte. In beiden Studien wurden subkutane bzw. intravenöse Formulierungen verwendet, um die beiden unterschiedlichen Darreichungsformen abzudecken. Hierbei wurden die Bioäquivalenz, Sicherheit und Immunogenität des Tocilizumab-Biosimilar-Kandidaten im Vergleich zu seinem Referenzprodukt untersucht.
Die erste Phase-I-Studie, eine randomisierte, doppelblinde Parallelgruppenstudie zur Bestimmung der PharmakokinetikPharmakokinetikDie Wirkung des Körpers auf das Arzneimittel., PharmakodynamikPharmakodynamikDie Wirkung des Arzneimittels auf den Körper., Sicherheit, Verträglichkeit und ImmunogenitätImmunogenitätDie Fähigkeit eines Antigens, eine Immunantwort (Immunisierung, Sensibilisierung) auszulösen. von MSB 11456 erfüllte alle primären und sekundären Endpunkte nach einer einmaligen subkutanen Injektion bei gesunden Probanden. Die pharmakokinetische Gleichwertigkeit von MSB 11456 mit dem US-Referenzprodukt4und dem EU-Referenzarzneimittel5 wurde erfolgreich nachgewiesen. Die klinische Studie bestätigte die Ähnlichkeit von MSB 11456 mit dem US-Referenzprodukt4 und dem EU-Referenzarzneimittel5 auf pharmakodynamischer Ebene. Es wurden keine nennenswerten Unterschiede in Bezug auf Sicherheit und Immunogenität zwischen den drei Behandlungsgruppen (MSB 11456, US-Referenzprodukt4und EU-Referenzarzneimittel5) festgestellt.
1 Idacio ist ein Biosimilar von Humira® und wurde noch nicht von allen Gesundheitsbehörden zugelassen. Humira® (Adalimumab) ist eine eingetragene Marke von AbbVie Biotechnology Ltd.
2 MSB 11455 ist ein Biosimilar-Kandidat zu Neulasta® und wurde noch nicht von den zuständigen Gesundheitsbehörden zugelassen. Neulasta® (Pegfilgrastim) ist eine eingetragene Marke von Amgen Inc.
3 MSB 11456 ist ein Biosimilar-Kandidat zu Tocilizumab und wurde noch nicht von den zuständigen Gesundheitsbehörden zugelassen. Actemra® / RoActemra® (Tocilizumab) sind eingetragen Marken der Chugai Seiyaku Kabushiki Kaisha.
4 US-Referenzprodukt Actemra®.
5 EU-Referenzprodukt RoActemra®.
Auch in der zweiten Phase-I-Studie wurden alle primären und sekundären Endpunkte erreicht und die pharmakokinetische Gleichwertigkeit von MSB 11456 und dem US-Referenzprodukt1 erfolgreich nachgewiesen. Es handelte sich bei dieser klinischen Studie ebenfalls um eine randomisierte, doppelblinde Parallelgruppenstudie zur Untersuchung der Pharmakokinetik, Sicherheit, Immunogenität und Verträglichkeit von MSB 11456 im Vergleich zu seinem US-amerikanischen Referenzprodukt1 nach einmaliger intravenöser Infusion bei gesunden Freiwilligen. Es wurden keine nennenswerten Unterschiede in Bezug auf Sicherheit und Immunogenität zwischen den beiden Behandlungsgruppen (MSB 11456 und US-Referenzprodukt1) festgestellt.
1 US-Referenzprodukt Actemra®.
2020 haben wir außerdem eine globale Phase-III-Studie eingeleitet, um die Wirksamkeit, Sicherheit, Verträglichkeit und Immunogenität unseres Tocilizumab-Biosimilar-Kandidaten MSB 11456 mit dem EU-Referenzprodukt bei Patienten mit mäßig bis schwer aktiver rheumatoider Arthritis zu vergleichen. Die Aufnahme von Patienten aus mehreren europäischen Ländern in diese Studie wurde 2021 abgeschlossen.
Klinische Ernährung dient der Versorgung von Patientinnen und Patienten, die keine oder nicht genügend reguläre Nahrung zu sich nehmen können. Dies betrifft beispielsweise Patientinnen und Patienten auf Intensivstationen sowie schwer und chronisch Kranke. Wird klinische Ernährung indikationsgerecht und frühzeitig eingesetzt, können Mangelernährung und deren Konsequenzen vermieden werden.
Mangelernährung ist eine häufige Indikation bei Krankenhauspatienten: Studien, die in Krankenhäusern in Europa durchgeführt wurden, zeigen, dass bei jedem vierten Patienten im Krankenhaus eine Mangelernährung bzw. das Risiko einer Mangelernährung vorliegt. Die klinische Bedeutung der Mangelernährung ergibt sich aus einer ungünstigeren Prognose hinsichtlich Morbidität und Mortalität. Weitere Folgen können ein längerer Krankenhausaufenthalt und höhere Behandlungskosten sein.
Im Produktsegment Parenterale ErnährungParenterale ErnährungZufuhr lebenswichtiger Nährstoffe direkt in die Blutbahn (intravenös). Sie wird notwendig, wenn der Zustand der Patientin oder des Patienten es nicht zulässt, dass Nährstoffe in ausreichender Menge oral oder als Trink- und Sondennahrung aufgenommen und verstoffwechselt werden. legen wir die Schwerpunkte im Bereich Forschung und Entwicklung auf Produkte, die maßgeblich zur Verbesserung der klinischen Behandlung und des Ernährungszustands von Patientinnen und Patienten beitragen, sowie auf Behältnisse wie beispielsweise unsere MehrkammerbeutelMehrkammerbeutelDer Mehrkammerbeutel enthält alle Makronährstoffe wie Aminosäuren, Glukose und Lipide sowie Elektrolyte in separaten Kammern. Erst unmittelbar vor der Infusion werden durch einfaches Öffnen der einzelnen Kammern alle Nährstoffe im Beutel vermischt. Dies verringert das Kontaminationsrisiko und führt zu Zeitersparnis bei der Vorbereitung von Infusionen., die im medizinischen Alltag sicherer und einfacher anwendbar sind.
Im Berichtsjahr haben wir unsere EuroPN-Studie abgeschlossen und erste Resultate auf internationalen wissenschaftlichen Fachkongressen dem medizinischen Fachpublikum vorgestellt. Mit der Studie wurde die klinische Ernährungspraxis bei mehr als 1.000 kritisch kranken Patienten in Europa untersucht. EuroPN ist aktuell die größte durchgeführte Längsschnittstudie, die die Auswirkungen von Ernährungszielen auf den Behandlungserfolg von kritisch kranken Patienten, die länger als 5 Tage auf einer Intensivstation behandelt wurden, untersucht. Die Veröffentlichung der Ergebnisse ist für 2022 geplant.
Begleitend zu unserer eigenen Entwicklung unterstützt Fresenius Kabi auch externe Entwicklungsprojekte, die dazu beitragen, die Ernährungsversorgung von kritisch kranken und Chirurgiepatientinnen und -patienten zu verbessern. Im Jahr 2019 haben wir das Förderprogramm „Jumpstart“ initiiert. Damit unterstützen wir die Forschungsarbeit junger Wissenschaftlerinnen und Wissenschaftler sowie Ärztinnen und Ärzte in Kliniken zum Thema parenterale Ernährungsversorgung. Eine unabhängige Jury, bestehend aus weltweit renommierten Wissenschaftlerinnen und Wissenschaftlern im Bereich der klinischen Ernährung, ist verantwortlich für die Auswahl der Stipendiatinnen und Stipendiaten und die Verleihung des Forschungspreises.
Im Berichtsjahr haben wir das Förderprogramm fortgesetzt und im September 2021 einen weiteren Forschungspreis auf dem internationalen Ernährungskongress ESPEN verliehen.
Im Jahr 2021 haben wir auch die Entwicklungsarbeit an parenteralen Produkten fortgeführt. Wir konzentrieren uns dabei auf Formulierungen, die auf die Bedürfnisse einzelner Patientengruppen ausgerichtet sind. Neben unseren globalen Entwicklungsprojekten arbeiten wir auch an Produkten zur parenteralen Ernährung für spezifische Märkte wie die USA, China und Europa.
Ein Schwerpunkt ist dabei der Einsatz von Fischöl in parenteraler Ernährung. Fischölhaltige parenterale ErnährungParenterale ErnährungZufuhr lebenswichtiger Nährstoffe direkt in die Blutbahn (intravenös). Sie wird notwendig, wenn der Zustand der Patientin oder des Patienten es nicht zulässt, dass Nährstoffe in ausreichender Menge oral oder als Trink- und Sondennahrung aufgenommen und verstoffwechselt werden. hat eine Vielzahl von positiven Auswirkungen auf wichtige biologische Funktionen einschließlich der Modulation der Immun- und Entzündungsreaktion. Der Einsatz von Fischöl in parenteralen Ernährungsprodukten trägt dazu bei, dass sich klinische Ergebnisse wie Infektionsraten, Sepsis-Raten oder die Aufenthaltsdauer auf der Intensivstation und generell im Krankenhaus verbessern können.
Im Bereich Enterale ErnährungEnterale ErnährungZufuhr von Nährstoffen als Trink- und Sondennahrung unter Einbeziehung des Magen-Darm-Traktes. konzentrieren wir unsere Forschungs- und Entwicklungsaktivitäten auf Produktkonzepte, die die Therapietreue und damit den Therapieerfolg unterstützen.
Insbesondere der Geschmack der enteralen Produkte ist als kritischer Parameter bekannt, um die Akzeptanz der Produkte und die Einhaltung der Ernährungstherapie zu gewährleisten. Seit Jahren arbeiten wir kontinuierlich daran, Produkte mit einer großen Vielfalt an Geschmacksrichtungen zu entwickeln, um den Anwendern Variationen anzubieten und sie damit bestmöglich zu unterstützen, die notwendige Ernährungstherapie durchzuführen. Ein weiterer Schwerpunkt unserer Arbeit ist die Entwicklung von Produkten mit erhöhter Kalorien- und Proteinkonzentration. Dadurch vereinfachen wir für den Anwender die Einnahme der notwendigen Menge an Nährstoffen in geringen Volumina. Neben globalen Produktentwicklungen arbeiten wir weiterhin an Produktentwicklungen für spezifische Markterfordernisse. Schwerpunktmäßig handelt es sich hierbei um Produkte für Märkte mit großem Wachstumspotenzial, z. B. in Asien für die Länder Taiwan und Korea sowie in Lateinamerika für Brasilien.
Im Bereich der Infusionslösungen arbeiten wir kontinuierlich an neuen Primärbehältnissen und bereits eingeführten Behältnissen, mit dem Ziel, die Effizienz und Sicherheit im Krankenhausalltag zu erhöhen und die Anwendung zu erleichtern. So haben wir im Berichtsjahr mit der Einführung unseres optimierten Infusionsbeutels freeflex+ mit nadelfreiem Injektionsanschluss begonnen. Ziel ist es, mit diesem Produkt dazu beizutragen, das Risiko möglicher Verletzungen im klinischen Alltag zu reduzieren. Des Weiteren arbeiten wir kontinuierlich an der Erweiterung unseres Produktangebots, das wir global einführen wollen. Ferner entwickeln wir Produkte, die für die weitere Erschließung des US-amerikanischen Marktes auch lokal produziert werden sollen.
Im Bereich Medizintechnische Produkte liegt der Schwerpunkt auf der Entwicklung von Neuprodukten sowie auf der Weiterentwicklung unseres bestehenden Portfolios. Gerade diese Branche ist geprägt von technologischen Innovationen. Wie in keinem anderen unserer Produktsegmente ist hier Digitalisierung ein entscheidender Faktor. Geräte müssen nicht nur in ihrer Anwendung kontinuierlich weiterentwickelt werden, sondern zunehmend auch in die IT-Systemlandschaft von Krankenhäusern, Blutspende- und Plasmazentren eingebettet sein. Perspektivisch wollen wir von diesem Trend profitieren und legen bereits jetzt einen Schwerpunkt auf die kontinuierliche Weiterentwicklung unserer Softwarelösungen zur Steigerung der Effizienz und des klinischen Ergebnisses unserer Kunden.
Im Berichtsjahr haben wir insbesondere die Entwicklung an der Vigilant Software Suite fortgeführt, eine Softwarelösung für unsere Infusionspumpenfamilie Agilia in Krankenhäusern. Als umfassendes, servergestütztes Therapieinformationssystem vereint es die zentrale Überwachung unserer Pumpen (Vigilant Sentinel), die zentrale Administration der am Patienten benötigten Medikamentendatenbanken (Vigilant Mastermed), ein umfassendes Qualitätsreporting (Vigilant Insight) und eine standardisierte IT-Schnittstellenapplikation (Vigilant Bridge). Neben der Weiterentwicklung forcieren wir auch die internationale Markteinführung durch weitere Sprachversionen, regulatorische Arbeiten und der Begleitung der Installation der Geräte in Krankenhäusern.
Ferner haben wir im Berichtsjahr die Entwicklungsarbeit an einem neuen Infusionsmanagementsystem fortgeführt. Dieses System ist mit einer modernen Bediensystematik ausgestattet und wird neue Therapie- und Behandlungsverfahren auf der Intensivstation und im Operationsraum ermöglichen.
Bei den medizintechnischen Einmalartikeln lag der Schwerpunkt auf der Entwicklung von Komponenten, die die Anwendungssicherheit und -einfachheit der Produkte erhöhen sowie die Therapie mit neuen Medikamenten erlauben.
In der Transfusionstechnologie arbeiten wir in der Forschung und Entwicklung intensiv an Produkten für den Einsatz im Bereich der Zelltherapie. Hierbei liegt unser Schwerpunkt auf Produktentwicklungen zum automatisierten Waschen und Aufkonzentrieren von Zellkonzentraten. Diese Produkte werden in der CAR-T-Zell¹ – und ähnlichen Zelltherapien – eingesetzt. Im Jahr 2021 haben wir mit den Vorbereitungen der Markteinführung des Zellverarbeitungsgeräts CUE¹ begonnen. Dieses Gerät wurde speziell für kleinere Füllmengen und Endanwendungen im Zelltherapiebereich entwickelt und wird unser bereits im Markt erhältliches Zellverarbeitungsgerät LOVO¹ ergänzen. Wir werden mit der Einführung von CUECUECUE ist ein automatisiertes Zellprozessiersystem, das weiße Blutzellsuspensionen für die Kryokonservierung (Einfrierung in flüssigem Stickstoff) und/oder zur Abgabe in finale Behälter wäscht, konzentriert und herstellt. im Jahr 2022 beginnen.
1 Weitere Informationen finden Sie im Glossar.
Im Bereich der extrakorporalen Photopherese (ECP) konzentrieren wir uns weiterhin auf die Einführung des Amicus Blue-Systems und der dazugehörigen Lichtbox Phelix in Europa sowie auf die weitere Entwicklung eines Anwendungsverfahrens bei der ECP, bei dem nur ein Gefäßzugang erforderlich ist. Bei diesem Therapieverfahren werden bestimmte Blutzellen außerhalb des Körpers einer Behandlung mit ultraviolettem Licht (Phototherapie) unterzogen. Dieses Verfahren wird für die Behandlung verschiedener immunologischer Erkrankungen eingesetzt, u. a., um bösartige Immunzellen (Lymphozyten) außerhalb des Körpers abzutöten.
Ein weiterer Schwerpunkt ist die kontinuierliche Weiterentwicklung unserer Geräte- und der dazugehörigen Datenverwaltungssoftware. Hierzu gehören die transfusionstechnischen Geräte für Plasma (Aurora Xi / Optimized Nomogram Software), Blutverarbeitung (Compoguard) und Blutplättchen (AmiCORE / Com tec advanced).

